Cell:新研究发现TGF-β和RAS信号通路共同促进肺腺癌转移
来源:生物谷原创 2024-09-20 12:00
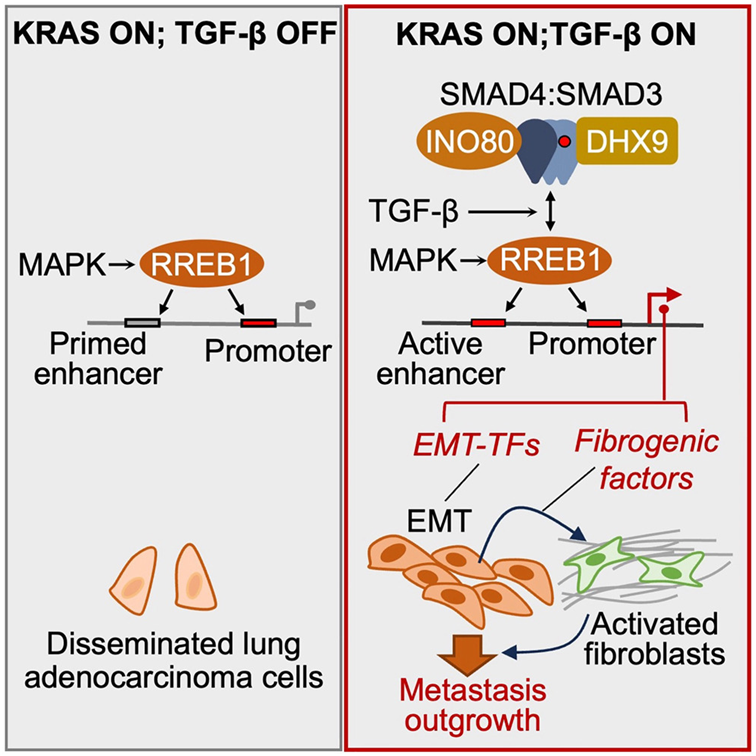
在这项研究中,研究者确定由RAS控制的一种转录因子(一种专门调节某些基因活性的蛋白质)在转移中起着关键作用。它就是RAS反应元件结合蛋白1(RREB1)。
谈及癌症转移,一句话总结就是一个巴掌拍不响。这是纪念斯隆-凯特琳癌症中心(MSK)研究人员领导的一项新研究的主要发现之一:TGF-β和RAS信号通路共同促进了肺腺癌的扩散,而肺腺癌是全球癌症死亡的主要原因。他们在动物模型中的研究结果表明移除这两种信号中的一种,肺癌就无法扩散(转移)到身体的新部位。这一发现为开发防止癌症转移的新方法开辟了新的途径。
相关研究结果于2024年9月6日在线发表在Cell期刊上,论文标题为“TGF-β and RAS jointly unmask primed enhancers to drive metastasis”。论文通讯作者为纪念斯隆-凯特琳癌症中心的Joan Massagué博士。

论文第一作者、Massagué实验室博士后研究员Jun Ho Lee博士说,“大约每10例癌症死亡病例中就有9例是由转移引起的。因此,了解、预防和治疗癌症转移的研究极有可能改善许多人的生活。”
两种信号通路——TGF-β和RAS的故事
就其本身而言,TGF-β——一种被称为细胞因子的信号蛋白,并不是理想的药物靶点。这是因为它在全身发挥着多种重要作用,因此几乎不可能在不产生重大副作用的情况下对它进行阻断。
TGF-β通常在调节胚胎发育和损伤修复的程序中发挥关键作用。但在癌细胞转移过程中,这些程序也会被激活,使原本无法移动的细胞具备移动和入侵组织的能力。然而,研究者发现在这种情况下,转移也需要RAS通路的输入。
RAS 的正常作用是从细胞外向细胞核传递信号,激活控制细胞生长、分裂和分化的基因。在这项研究中,研究者确定由RAS控制的一种转录因子(一种专门调节某些基因活性的蛋白质)在转移中起着关键作用。它就是RAS反应元件结合蛋白1(RREB1)。
他们发现,RREB1与一种名为SMAD4的信号复合物合作,后者受TGF-β控制。抑制RREB1可以阻止小鼠模型中的转移过程,这表明它可能成为肺癌和肺纤维化等相关疾病的潜在新药靶点。
为何TGF-β在癌症转移中发挥作用的关键在于环境
这项研究汇集了Massagué实验室两个长期研究领域:TGF-β信号转导和转移。Massagué博士因他揭示了TGF-β信号传导的作用机制的开创性工作而闻名于世。
TGF-β蛋白家族在许多不同类型细胞的增殖和分化中发挥着关键作用,控制着从胚胎到成年期的组织形成和再生。
Massagué博士说,“我们知道TGF-β通路能促进损伤修复,抑制健康组织中肿瘤的形成,但当肿瘤生长时,它又会促进肿瘤转移。因此,这是我们想弄明白的一个大问题:转移是如何利用正常存在的东西来保持组织健康,并利用它来促进转移性生长的?这导致了我实验室的整个研究项目。”
图片来自Cell, 2024, doi:10.1016/j.cell.2024.08.014
另一种说法是,TGF-β能帮助正常细胞再生,但一旦被癌症利用,这种再生就会变成失控的生长,而不是健康的更新。
在这项新的研究中,研究者对这一过程中的作用机制进行了新的阐释,揭示了癌症转移需要RAS和TGF-β的输入---至少在这种最常见的肺癌中,纤维瘢痕组织的生长是一个关键组成部分。
除了癌症,TGF-β驱动的肺纤维化也影响着全球成千上万的人。虽然靶向TGF-β很有前景,但长期使用TGF-β抑制剂治疗转移性癌症或肺纤维化可能会导致严重的副作用。Massagué 博士指出比如,干扰TGF-β的作用会导致免疫系统过度活跃。
他说,“因此,生物技术行业一直在寻找仅靶向TGF-β的局部或限制性方法。在这项研究中,我们发现了一种新的候选药物,可以进行这种类型的干预,只是集中在一个伴侣信号上,我们如今知道转移和纤维化也需要这个信号。”
进一步了解癌症的扩散能力
这项研究是纪念斯隆-凯特琳癌症中心为揭示癌症如何发展和扩散而做出的更广泛努力的一部分。Massagué博士解释说,“在研究癌症与它生长的环境,即我们称之为‘肿瘤微环境’之间的相互作用时,我们开始揭示癌症程序是如何由特定信号驱动的,其中涉及改变癌症行为的预先建立的反应模式。”
在这项研究中,肿瘤微环境包括制造胶原纤维的成纤维细胞。Massagué博士说,此外,像这样试图了解癌细胞转移背后力量的研究还进一步揭示了受伤后组织的整体维护和再生是如何严密组织和协调的。他说,“我们可以将这些认识扩展到其他肿瘤类型、体内发生转移的其他器官以及其他形式的纤维化。”(生物谷Bioon.com)
参考资料:
Jun Ho Lee et al. TGF-β and RAS jointly unmask primed enhancers to drive metastasis. Cell, 2024, doi:10.1016/j.cell.2024.08.014.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


